第2回:電池の原理~どうやって電気を貯めるの?


今回は、電池について解説する最初のコラムです。
電池の分類をはじめ、電気を発生させたり、貯めたりする原理を解説していきます。
 分類と代表例
分類と代表例
電池とは、「電気を放出したり、貯めたりできるデバイス」のことです。
しかし、電気を放出したり貯めたりできるものは、電池以外にも存在します。下記は、「蓄電池」の大まかな分類です。
《化学電池》
一次電池 マンガン電池、アルカリ電池、リチウムイオン電池、酸化銀電池
二次電池 鉛蓄電池、ニカド電池、ニッケル水素電池、リチウムイオン電池、燃料電池
《物理電池》太陽電池
《キャパシタ・コンデンサ》
セラミックスコンデンサ、アルミ電解コンデンサ、電気二重層キャパシタ、リチウムイオンキャパシタ
自動車やスマホなどの電池は、二次電池と呼ばれ、「化学反応」を利用しています。
化学反応を用いず、物理反応を利用する物理電池や、電子で電気を物理的に蓄え、放出するコンデンサ、イオンで電気を物理的に蓄え、放出するキャパシタも蓄電池です。
各蓄電池の特長を理解するために、まずは最も身近な二次電池について見てみましょう。
 二次電池の原理
二次電池の原理
二次電池(以降、電池と記載)では具体的には、金属が「エネルギーを与えてイオン化可能」という性質を利用し、電池の中で化学反応を起こすことで電気の充放電を可能にしています。
電池には大きく分けて①電極(正極・負極)②電解質(電解液)③セパレータ(絶縁)の3つの主要部材が必要です。さらに、電極は活物質と集電体から組み立てられています。
電極は化学エネルギーを蓄える・化学反応を起こす材料部品です。負極から正イオンが離れる時、「電子(e-)」が負極から放出され、正極に移動することで放電が起きます。
充電のときは、逆に電子(e-)が正極から負極に移動しています。
金属を水などに浸した際、水によって電子を奪われて陽イオンへ変化しやすい度合いを表したものを 「イオン化傾向」(イオン化列)と言います。
異なる2種類の金属元素が存在するとき、イオン化傾向が大きい金属の方が優先して陽イオンになります。
この性質を利用して、負極側の金属がイオンになることで電子が正極に移動し、電気を発生させています。
参考|充放電時の電池内部の変化
(リチウムイオン二次電池)
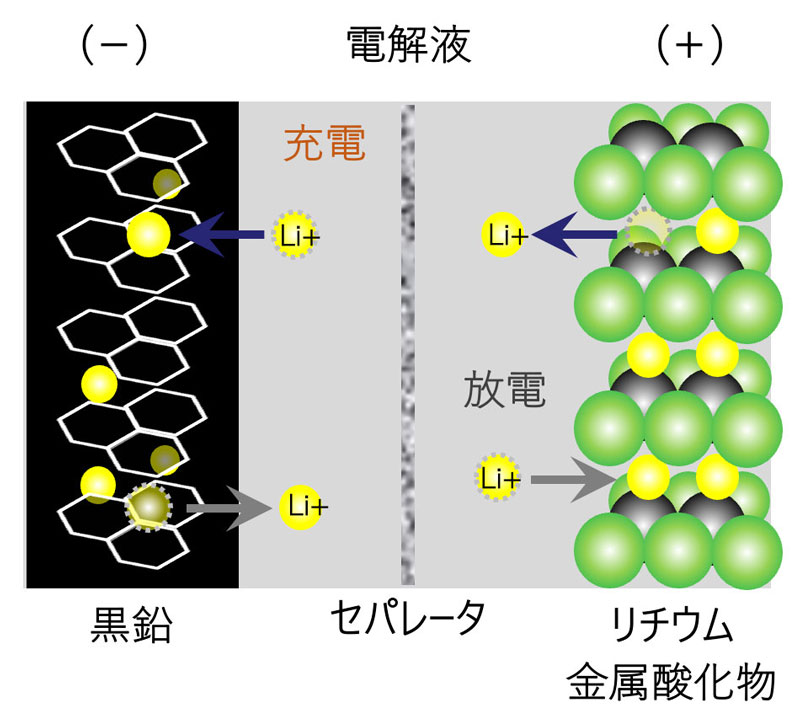

電池で使う電極以外の材料について(一部解説)
○電解質
電子を通さず、電池反応に必要なイオンを受け渡す役割を担っています。電子を通してしまうと、内部短絡が発生し、発熱・発火の危険性が高くなります。
○セパレータ
正極と負極の間に配置され、両極を分離・絶縁する役割を担います。外部からの衝撃や電池反応による電極形状の変化等により、正極・負極が直接触れ、内部短絡する危険性を低くします。
※内部短絡とは
電池内部で正極と負極を直接触れると発生する現象で、大きな電流が一気に流れ、発熱につながります。電解液が非水系(有機溶媒)の場合、内部短絡で火花が散ると、電解液に火が燃え移り、火災につながる危険が高まります。
 電池の歴史
電池の歴史
現在の電池に近いものは、産業革命が起きた18世紀~19世紀に発明されました。発明者の名前に因み、「ボルタ電池」と呼ばれます。
この電池は一度反応が起きると「負極の反応を止めることができない」・「起電圧が低く、さらに正極の周りに水素がまとわりつき、電解液との接触を妨げてしまう」という現象が発生し、電気を溜めておけず、電気を好きなときに使うことができないという欠点がありました。
しかしながら、このボルタ電池の開発から、様々な研究が進み、リチウムイオン電池や鉛蓄電池など、現在では多様な蓄電池が誕生しています。

一次電池とは?
一次電池は二次電池と違い、再充電して使用できない電池です。マンガン電池、アルカリ電池といった乾電池をはじめ、ガスメーターや水道メーター、車のキーレスエントリー等に使用されるリチウムイオン電池があります。
 まとめ
まとめ
今回は、蓄電池の種類と、電池の基本原理についてご紹介しました。
次回は、自動車や産業機械をはじめ、現在様々な用途で使用される代表的な電池についてご紹介していきます。
お楽しみに!
注記|本コラムにおける技術情報は、当社および第三者の知的財産権他の権利に対する保証または実施権を許諾するものではありません。また、一部の内容に主観的な解釈・意見を含むことをお含みおき頂きますようお願い致します。
関連コラム
- 第1回:カーボンニュートラルに向けた電動化の動向
- 第3回:代表的な電池-前編(鉛蓄電池・ニカド電池・ニッケル水素電池)
- 第4回:代表的な電池-後編(リチウムイオン二次電池)
- 第5回:キャパシタ・コンデンサって何?~電池と何が違うの?~
- 第6回:スペック(性能)の意味と見方
- 第7回:蓄電池どれ使う?&どう使う?
高耐熱リチウムイオンキャパシタ関連ページ
 |
 |
 |


