第3回:代表的な電池-前編(鉛蓄電池・ニカド電池・ニッケル水素電池)


自動車や産業機械など、様々な場面で電池は使用されますが、その種類は様々です。
第3回・第4回の二回にわたり、代表的な電池の構成や特長を解説していきます。
今回は、鉛蓄電池、ニカド電池、ニッケル水素電池の3つの電池を取り上げます。
 鉛蓄電池
鉛蓄電池
まずは、「鉛蓄電池」についてです。
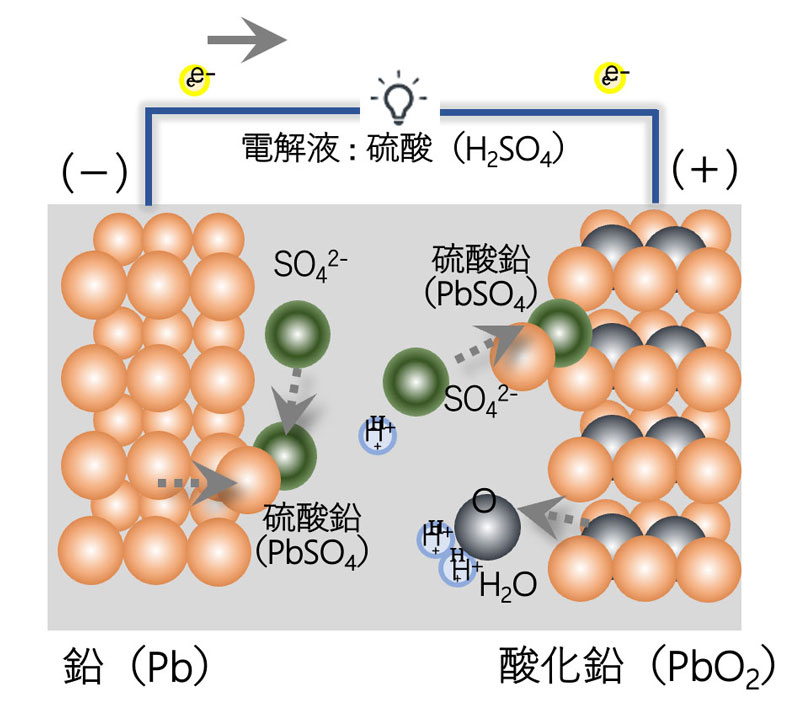
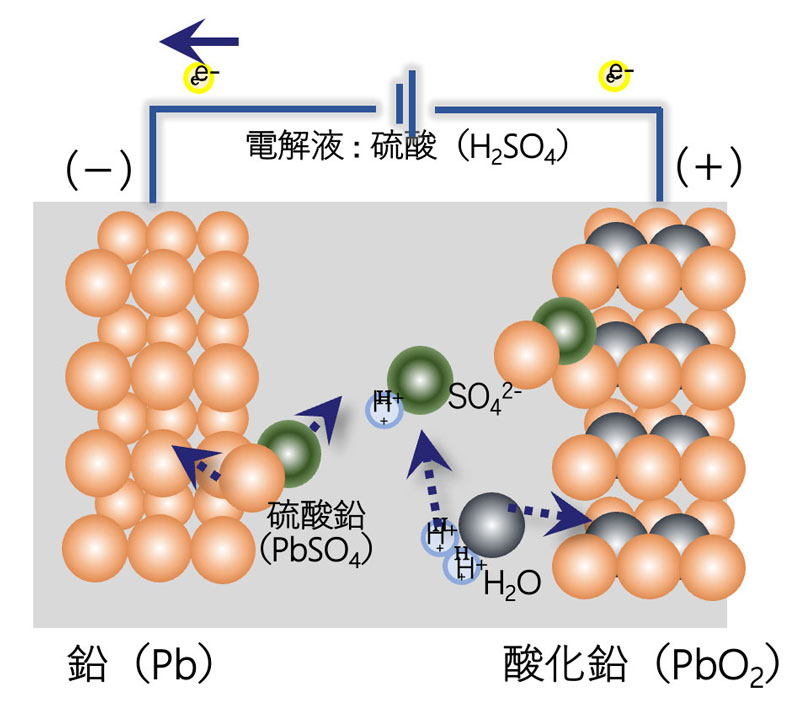
19世紀にフランスで発明された最も古い二次電池と言われており、一負極に鉛(Pb)、正極に酸化鉛(PbO2)、電解液に硫酸の水溶液を使用しています。
単電池(セル)では2Vの電圧が得られ、通常、自動車用途等では、6個直列し12Vの電圧が得られるようにしています。
現在の主な使用例は、エンジンスターター等の始動用バッテリーやゴルフ場の電動カート、フォークリフト向けディープサイクルバッテリーです。
用途に合わせた研究開発が進んでおり、始動用は容量の数%を一気に放電できる一方、深く使用する(空っぽになるくらい放電する)と鉛の消耗が激しくなり、性能低下につながります。一方、ディープサイクル用は同じような出力で長時間使用を想定しているため、深い放電にも対応できる設計になっています。
※一般的に大きな電流を流す場合には、定格容量の分の電気を取り出すことは難しいですが、小さな電流の場合は、定格容量の電気を使用できます。詳しくは別の回で解説します。
鉛蓄電池の使用上の注意点として、「サルフェーション」が起きてしまう点があげられます。これは、電極の周りに鉛に反応した硫酸によって硫酸鉛がまとわりつき、電解液に溶け出さなくなる現象です。自動車でたまに起きる「バッテリー上がり」のように、電池が使えなくなってしまいます。
 ニカド電池・ニッケル水素電池
ニカド電池・ニッケル水素電池
続いて、「ニカド電池・ニッケル水素電池」です。
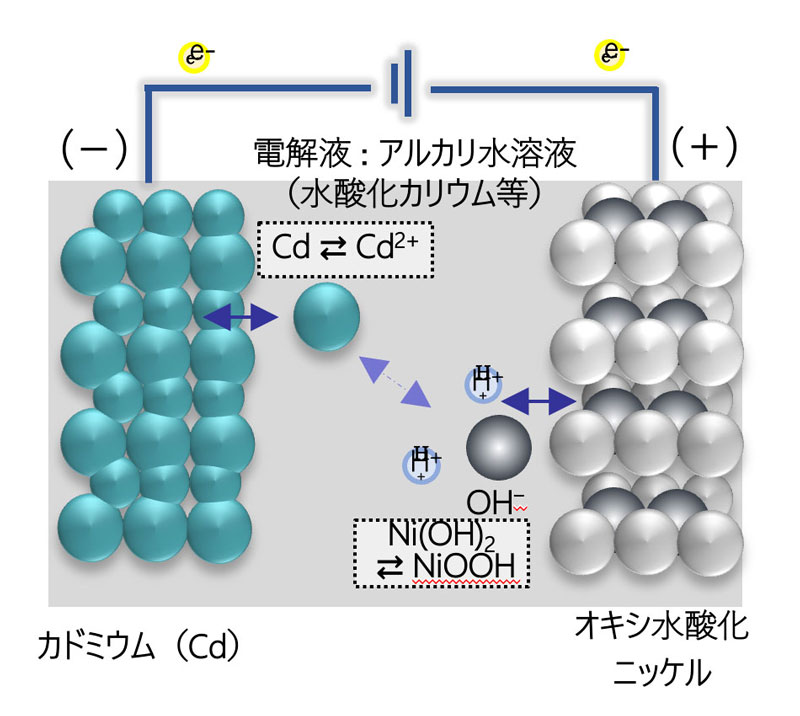
ニカド電池(Ni-Cd)は、正極にオキシ水酸化ニッケル(NiOOH)、負極にカドミウム(Cd)、電解液にアルカリ性水溶液(水酸化カリウム)を使用する電池です。
H+イオンの移動により反応のみで、正極の溶解・析出が発生しない点が、鉛蓄電池との違いです。
公称電圧は1.2Vです。
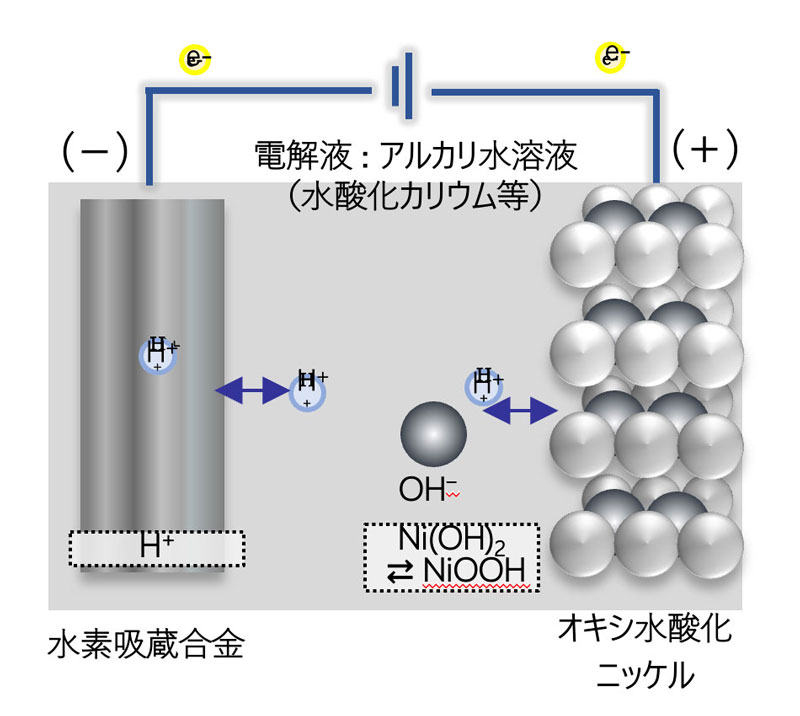
ニッケル水素電池(Ni-MH)は、正極はニカド電池と同様、オキシ水酸化ニッケル(NiOOH)を使用し、負極には水素の吸蔵・放出を行う「水素吸蔵合金」を使用しています。
正極・負極ともに溶解・析出反応を起こさないため、より電極に負担がかからなくなっています。
電圧は1.25Vで、同等の電圧を持つアルカリ電池やマンガン電池、ニカド電池からの置き換え用途として利用されています。また、ニカド電池と比較し、2倍以上のエネルギー密度があります。
どちらの電池も鉛蓄電池に比べ、エネルギー密度が高く、温度特性に優れていますが、デメリットとして、自己放電が大きい、メモリー効果が起きやすい点があげられます。

メモリー効果とは
まだ残量がある状態で充電すると、充電を開始した時の残量が基準となってしまい、本来の容量よりも 少ない容量までしか充放電できなくなること。また、ニカド電池に関しては、イタイイタイ病を引き起こしたカドミウムを使用しているため、環境負荷への懸念が高まり、ニッケル水素電池やリチウムイオン電池への置き換えが進み、現在では一部の用途に限定されています。
 まとめ
まとめ
今回は鉛蓄電池、ニカド電池、ニッケル水素電池をご紹介しました。
次回は、リチウムイオン二次電池についてご紹介します。
お楽しみに!
注記|本コラムにおける技術情報は、当社および第三者の知的財産権他の権利に対する保証または実施権を許諾するものではありません。また、一部の内容に主観的な解釈・意見を含むことをお含みおき頂きますようお願い致します。
関連コラム
- 第1回:カーボンニュートラルに向けた電動化の動向
- 第2回:電池の原理~どうやって電気を貯めるの?
- 第4回:代表的な電池-後編(リチウムイオン二次電池)
- 第5回:キャパシタ・コンデンサって何?~電池と何が違うの?~
- 第6回:スペック(性能)の意味と見方
- 第7回:蓄電池どれ使う?&どう使う?
高耐熱リチウムイオンキャパシタ関連ページ
 |
 |
 |


